本文将CRISPR-Cas12a系统与MRS传感相结合,构建基于CRISPR-Cas12a系统的MRS生物传感器检测沙门氏菌。充分利用MNPs作为磁分离工具和信号标签的双重功能,为生物传感器的设计提供了新思路。同时,得益于CRISPR-Cas12a系统的高特异性和MRS检测的高灵敏度,该生物传感器对沙门氏菌具有良好的检测性能。
构建基于CRISPR-Cas12a的MRS生物传感器检测沙门氏菌。引入小粒径的MNPs作为磁信号探针,开发MNPs产生信号的新功能。该生物传感器通过CRISPR-Cas12a系统在目标物存在下对biotin-S1的切割作用控制两种不同粒径MNPs的结合,然后利用大小粒径MNPs磁分离速度的差异,以溶液中游离的小粒径MNPs为信号输出分子检测沙门氏菌。得益于CRISPR-Cas12a系统的高特异性和高效切割活性以及MRS检测方法的高灵敏度,该生物传感器对纯菌液和鸡肉提取液加标样品中沙门氏菌的LOD分别为1.3×102 CFU mL-1和1.8×103 CFU mL-1,且可避免重复磁分离与洗涤,操作更为简便。
MNPs可作为MRS传感检测中的磁性探针。传统的基于MNPs聚集/分散状态改变的MRS生物传感方法易受样品基质干扰,稳定性较差。基于MNPs数量变化的MRS生物传感器已经得到了较好的发展。但是以上方法需要目标物自身提供位点以控制大小粒径MNPs之间的结合。目标物的表面位点有限且可能发生非特异性结合,因而检测灵敏度会受到影响。为此,本文将CRISPR-Cas12a系统与MRS传感技术相结合,利用CRISPR-Cas12a系统精准控制两种不同粒径MNPs之间的结合,开发基于CRISPR-Cas12a的MRS生物传感器检测沙门氏菌。
如图1所示,分别在粒径为130 nm和30 nm左右的MNP130和MNP30表面修饰SA和S2,制得SA修饰的MNP130(MNP130-SA)和S2修饰的MNP30(MNP30-S2)探针。当目标物存在时,Cas12a、crRNA和靶标DNA形成三元复合体,并激活trans切割活性以非特异性切割biotin-S1。因此,MNP30-S2无法通过S1和S2之间的碱基互补配对作用结合至MNP130-SA表面,在磁场作用下仍分散在溶液中。反之,大量MNP30-S2结合至MNP130-SA表面,并在磁场作用下被分离。最后,以清液中游离的MNP30-S2为探针,通过横向弛豫时间T2的测定检测沙门氏菌。
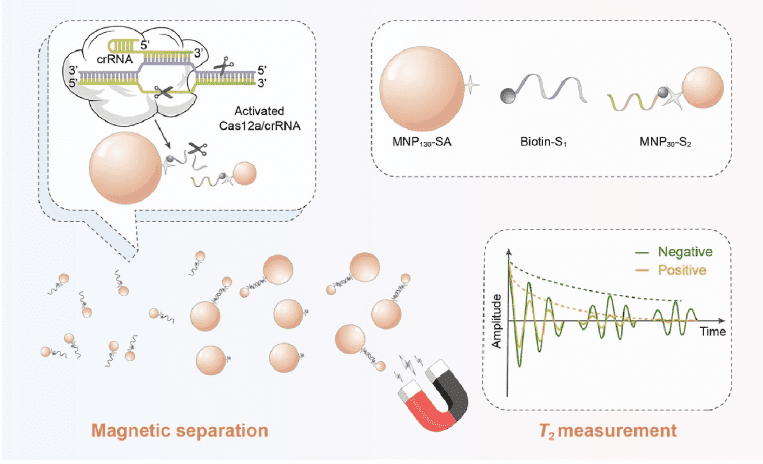
图1
纽迈核磁助力:利用低场核磁设备(PQ001,纽迈电子科技有限公司,上海,中国)测量获得样品的横向弛豫时间T2。在测定T2时,仪器的温度精确设置为32±0.01°C。利用硬脉冲序列Q-FID校准仪器中心频率O1及寻找90o射频脉宽P1和180o脉宽P2。然后,利用Carr-Purcell-Meiboom-Gill(CPMG)脉冲序列进行T2的测量。
1:利用TEM表征MNP130-SA在有无目标物存在下的表面状态。如图2A所示,MNP130-SA的粒径为130 nm左右;而MNP30-S2的粒径在30 nm左右。在无目标物存在下,MNP130-SA捕获biotin-S1,并与MNP30-S2结合,因此MNP130-SA表面结合了大量MNP30-S2。而当目标物存在下,Cas12a/crRNA复合体的trans切割活性被激活,使biotin-S1被非特异性切割,从而影响MNP130-SA与MNP30-S2之间的结合。因此MNP130-SA周围仅有极少量MNP30-S2的存在。以上TEM表征结果证明了该生物传感器检测S. Typhimurium具备可行性。
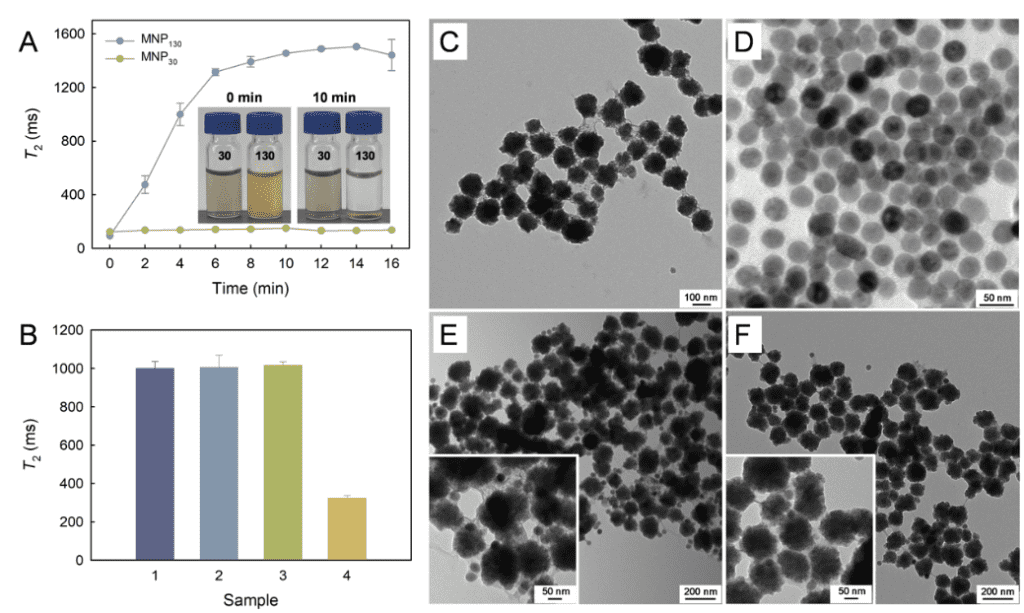
图 2
2:考察切割方式对检测效果的影响。即方案1:先将biotin-S1偶联至MNP130-SA表面制得MNP130-S1,然后利用CRISPR-Cas12a系统切割MNP130表面的S1;方案2:切割溶液中游离的biotin-S1,然后加入MNP130-SA进行捕获。采用方案1时,利用肉眼观察分散性变化即可实现目标物的定性检测,简单方便,但是灵敏度较低;而采取方案2则可显著提高MRS生物传感器对目标物的响应。为提高检测灵敏度,在后续实验中继续采取方案2的切割方式检测沙门氏菌。
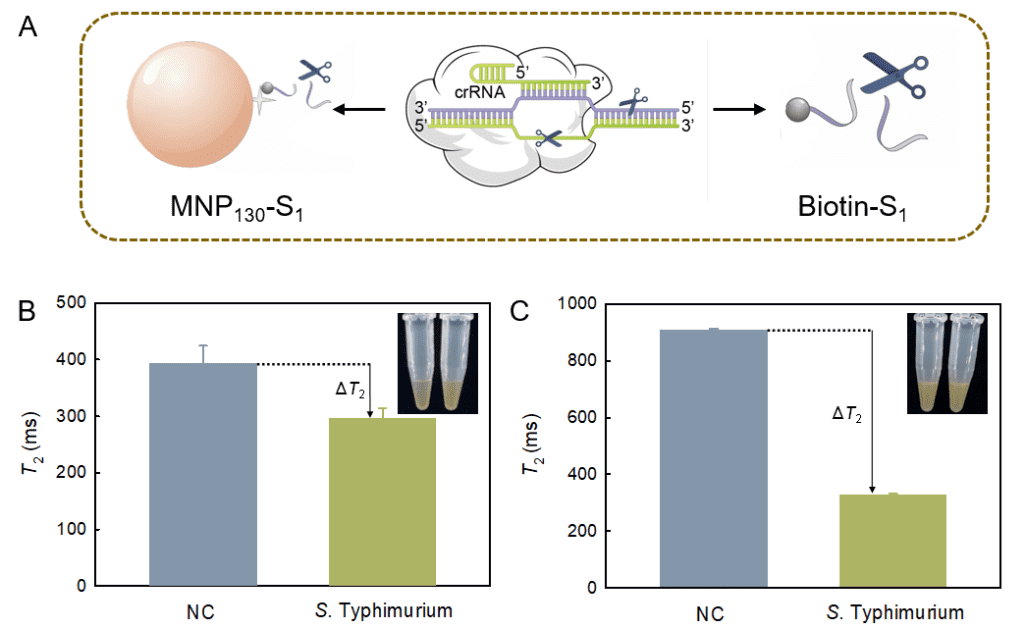
图 3
3:从图4可以看出,1.3×102 CFU mL-1细菌浓度下的T2值已低于阈值线,说明该方法可对1.3×102 CFU mL-1的S. Typhimurium进行检测,其LOD明显低于大部分已报道的MRS生物传感器。对鸡肉提取液加标样品中的S. Typhimurium进行检测。该方法对鸡肉提取液中S. Typhimurium的LOD为1.8×103 CFU mL-1。将纯菌液和鸡肉提取液中的检测结果进行对比发现,鸡肉提取液中103 CFU mL-1细菌引起的信号响应明显高于纯菌液(ΔT2%分别为10%和47%)。为评估该生物传感器对沙门氏菌的特异性,选取S. aureus、E. coli O157:H7、V. parahaemolyticus和L. monocytogenes四种常见食源性致病菌作为考察对象。S. Typhimurium和四种非目标菌的浓度均为105 CFU mL-1。如图所示,相较于空白对照,非目标菌引起的信号变化率均在5%以内,而目标物S. Typhimurium则可引起60%以上的信号下降,体现了该生物传感器良好的特异性。
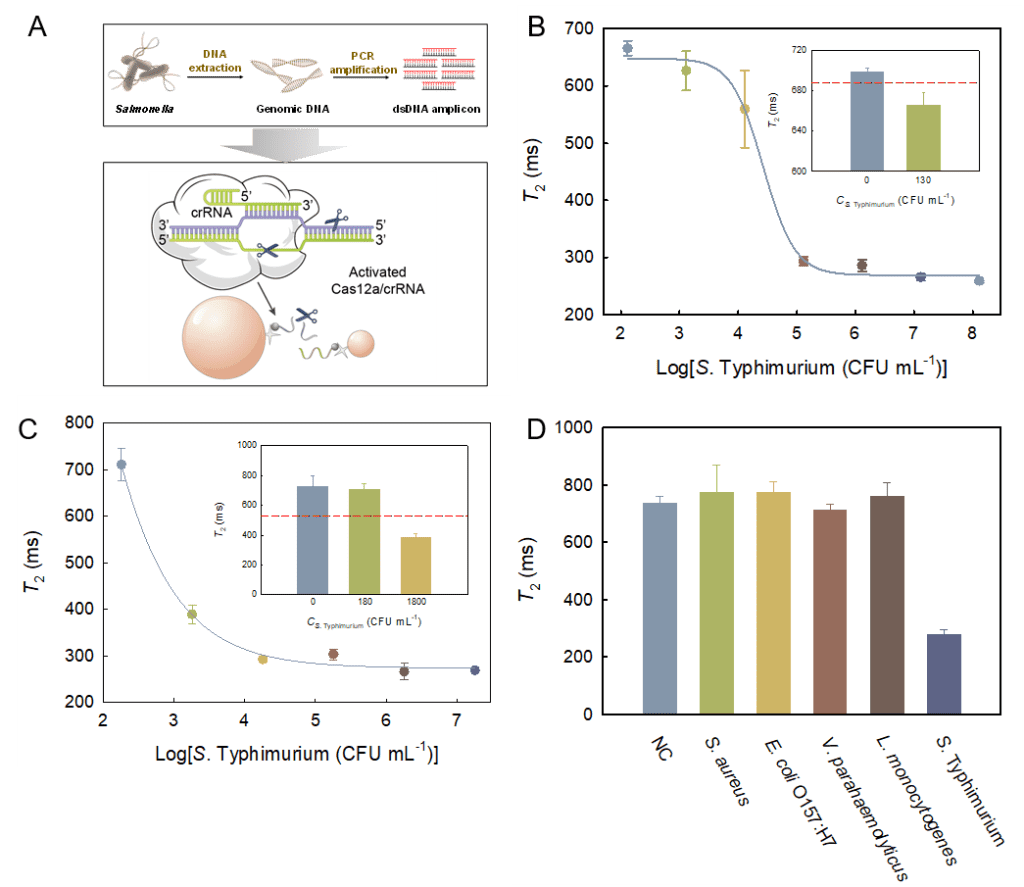
图 4
本文提出了一种基于CRISPR-Cas12a系统的MRS生物传感器检测沙门氏菌。该方法利用CRISPR-Cas12a系统控制两种不同粒径MNPs的结合,并以游离的小粒径MNPs为磁性探针实现MRS信号输出,对纯菌液和鸡肉提取液加标样品中S. Typhimurium的LOD分别为1.3×102 CFU mL-1和1.8×103 CFU mL-1。该方法充分利用了MNPs作为磁分离载体和信号标签的双重功能。此外,检测磁分离后的清液省去了繁琐的重复洗涤操作,简化了检测步骤。通过设计特定的crRNA,该方法亦可拓展至其他目标物的检测,具备一定的通用性。
该研究工作得到了国家自然科学青年基金,沃尔玛基金会和沃尔玛食品安全协作中心的的资助与支持。

电话:400-060-3233
售后:400-060-3233


返回顶部