
研究人员采用了一种很有前景的干燥技术,即冷冻干燥和远红外干燥(FD-FIRD)联合技术,对种子用南瓜(SUP)进行脱水,并评估了其对南瓜的物理特性(颜色、微观结构、质地、收缩率)、生物活性成分(酚类和类胡萝卜素)的影响。低场核磁共振(LF-NMR)用于分析脱模过程中的水分状态和分布,这有利于选择合适的水分转移点。结果表明,当干燥时间达到 25 小时时,大部分游离水(87.29%)被去除,从而保留了样品的原始组织结构,在后期的热固性脱脂过程中几乎没有变形。因此,干燥 25 小时后再进行 2 小时热固性脱脂(FD25-FIRD2)的样品与干燥脱脂样品的外观相似。FD-FIRD 样品的游离酚含量比 FD 样品高 14.97 %-26.60 %,这取决于 FIRD 的持续时间。特别是 FD25-FIRD2 样品的对香豆酸含量增加了 32.23%。此外,FD-FIRD 的类胡萝卜素保留率比 FIRD 高 3.00-3.39 倍。
籽用南瓜(Cucurbita maxima Duch.)由于其种子丰富的营养价值而受到越来越多的关注。然而,籽用南瓜果肉的工业化利用仍然受到限制。此外,新鲜籽用南瓜含水量高,易腐烂变质,不利于贮运。以往的研究表明,不同的干燥方法会显著影响新鲜原料的质量。冷冻干燥(FD)又称升华干燥,通过固态冰的升华去除产品中的水分。由于低温和低压环境,与其他干燥方法相比,冷冻干燥能生产出外观更好、营养保留率更高的优质干燥产品。然而,FD 是一种耗时耗力的工艺,限制了它在食品工业中的应用。因此,有必要在保持干燥产品品质的同时,减少干燥过程中的长时间和高能耗。近年来,研究人员通常将 FD 与热风干燥、远红外辐射干燥(FIRD)和微波干燥等其他各种干燥方法结合使用,以达到上述目的。与各种组合干燥方法相比,FD 与 FIRD 的组合(FD-FIRD)因 FIRD 的干燥特性而受到越来越多的关注。因此,本研究的目的是:(i) 根据 SUP 切片的水分状况和分布,选择适当的水分转移点;(ii) 研究 FD-FIRD 对 SUP 切片的外观(颜色、微观结构)、物理属性(硬度、收缩率)和生物活性化合物(游离酚、酚酸、类胡萝卜素总量和 β-胡萝卜素)的影响。

表1. 籽用南瓜片的综合干燥阶段和颜色参数
表 1 列出了用 FD、FIRD 和 FD-FIRD 脱水的 SUP 切片的颜色参数。不同干燥技术脱水的 SUP 切片的 L*、a* 和 b* 值差异显著(p < 0.05)。与其他干燥方法相比,FD 样品的 L* 值最高(87.22 ± 1.21),这与 FD 过程中天然色素的保留更好有关。这与我们之前的研究结果一致,即冻干样品的 L* 值最高,其次是冻干样品和热风干燥样品(Chao 等人,2022 年)。此外,FD-FIRD 样品的 L* 值高于 FIRD 样品,其顺序如下:FD35-FIRD1 > FD35-FIRD1 > FD35-FIRD1 > FD35-FIRD1:FD35-FIRD1>FD25-FIRD2>FD15-FIRD4。此外,用热风干燥法干燥的 SUP 切片显示出最高的 a*(8.58 ± 0.31)和 b*(57.03 ± 1.12)值,表明热风干燥法产品的表面颜色更红、更黄。脱水 SUP 样品的图片(表 1)也直观地证实了这一点。这种现象不仅可能是由于在热固性脱脂过程中发生了一系列复杂的 Maillard 反应,还可能是由于类胡萝卜素的含量和构型发生了变化。南瓜富含类胡萝卜素,是干燥过程中颜色变化的主要原因。
用放大 7.8 倍和 100 倍的体视显微镜(SM)可进一步观察干燥 SUP 切片的微观结构差异。如表 1A-a 所示,FIRD 样品出现裂缝、沟壑和粗糙表面。这是因为热处理会促进组织分解、细胞变形和不规则细胞间隙的形成,即细胞壁降解和细胞膜破裂。同样,FD15-FIRD4 样品的表面也出现了不规则裂纹(表 1B-b)。这是因为当 FD 过程持续 15 小时时,SUP 切片仍含有较高的自由水含量(56.58%),表明大量冰晶尚未完全升华,仍残留在样品中,离初级阶段结束还很远。在这种情况下,在随后的 FIRD 过程中冰的融化会导致样品出现裂纹。不过,FD25-FIRD2 和 FD35-FIRD1 样品的结构相对均匀,组织排列紧密,与 FD 样品的外观相似。这可能与脱脂持续时间为 25 小时时大部分游离水已被去除,从而保持了样品结构的完整性有关。总之,FD25-FIRD2 可以缩短 18 小时的干燥时间,同时保持与单一 FD 相似的良好形态。
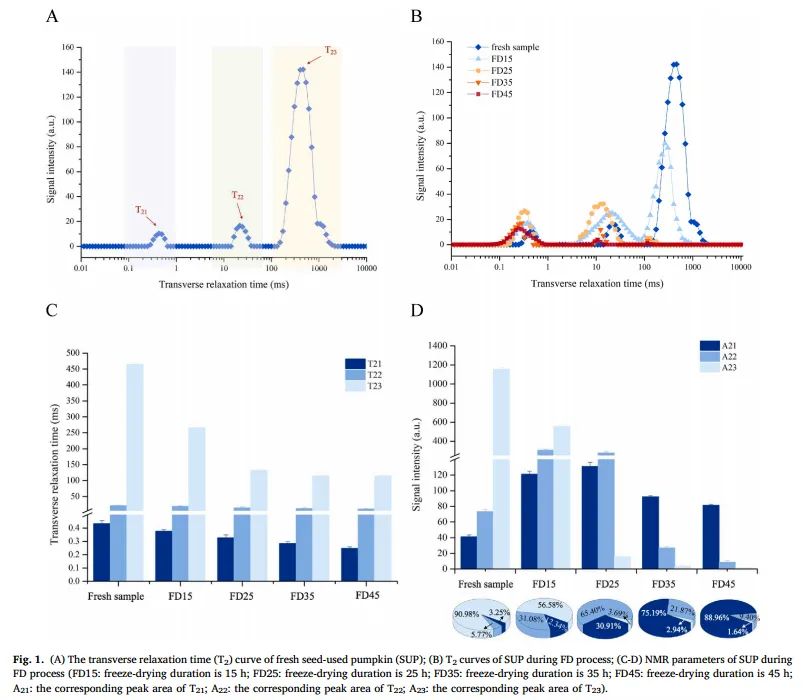
图1. (A) 鲜种用南瓜(SUP)的横向弛豫时间(T2)曲线;(B) 南瓜在冻干过程中的 T2 曲线;(C-D) 南瓜在冻干过程中的 NMR 参数(FD15:冻干时间为 15 小时;FD25:FD35:冷冻干燥持续时间为 35 小时;FD45:冷冻干燥持续时间为 45 小时;A21:T21 对应的峰面积;A22:T22 对应的峰面积;A23:T23 对应的峰面积)
如图 1A 所示,新鲜 SUP 的 T2 波谱有三个谱峰,分别代表三种不同的水分状态,即与细胞壁中多糖结合的结合水(T21,在 0.1-1 ms 范围内)、介于自由水和结合水之间自由度的不动水(T22,在 10-100 ms 范围内)、容易与细胞质和细胞外大分子结合的自由水(T23,在 100-10000 ms 范围内)、与样品弱结合的自由水。总信号振幅与 SUP 样品中氢质子的数量成正比,因此 T2 曲线各峰值所覆盖的信号振幅可表示相应水分状态(分别为 A21、A22、A23)的相对含量。
从图 1B-C 中可以看出,在整个脱模过程中,随着干燥时间的延长,SUP 样品的 T2 弛豫时间和信号振幅(峰面积)普遍减小。总峰面积的减小归因于脱模过程中水分的减少。如图 1B 所示,A23的减小表明在初级干燥阶段,冻结的游离水首先通过升华从材料中去除。初级干燥结束后,剩余的结合水在解吸干燥过程中被去除。此外,T2 反转光谱趋向于向左 x 轴移动(T21:从 0.43 移动到 0.25;T22:从 21.54 移动到 10.72;T23:从 464.16 移动到 114.98)。其他研究也观察到了干燥过程中松弛时间的左移。弛豫时间可以反映样品中水结合力和自由氢质子的程度。横向弛豫时间越短(弛豫时间左移),表明自由氢质子的程度越小,水结合力越强。这是因为自由水的减少引起了大分子物质(如碳水化合物、蛋白质等)浓度的增加,促使水与大分子紧密结合,从而导致水的流动性降低。
从图 1D 可以看出,随着干燥过程的进行,自由水信号 A23 的振幅逐渐减小,干燥结束时其相对含量减少了近 90%。当干燥时间达到 15 h 时,游离水的比例为 56.58 %。这表明当脱硫过程持续 15 h 时,样品中仍有大量冰晶没有完全升华,离升华干燥结束还很远。值得注意的是,当干燥时间达到 25 小时时,游离水的相对含量下降了87.29%。这一现象与样品中的游离水一般都被冻结,在升华干燥阶段可被大部分去除有关。同时,随着脱水过程的进行,不流动水含量(5.77%,新鲜样品)也在增加,当干燥时间达到 25 小时时,不流动水含量随之减少。这一现象表明,在干燥过程中,游离水不断被去除,部分游离水转移到了不流动水中。同时,样品中的湿度梯度也促进了不动水向结合水的迁移。在干燥后期(干燥时间持续 35 小时),SUP 切片主要由结合水(88.96 %)组成,这些结合水通过强氢键与蛋白质、细胞壁多糖(纤维素、半纤维素、半纤维素、纤维素和纤维素)紧密结合。
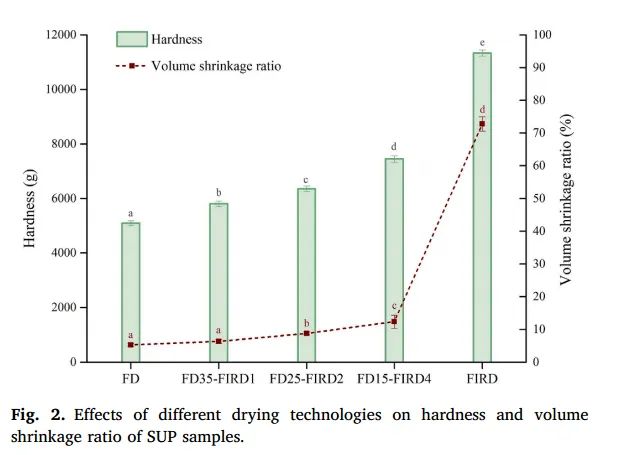
图2. 不同干燥技术对 SUP 样品硬度和体积收缩率的影响
收缩率是干制品的一种普遍物理现象,经常被用作揭示最终产品外观的重要指标。干 SUP 切片的体积收缩率如图 2 所示。冻干样品的体积收缩率最小(5.28 ± 0.52 %),也就是说,其结构的完整性得到了更好的保护。相反,FIRD 样品的体积收缩率明显更大(72.77 ± 2.18 %)。FIRD 引发的严重收缩可归因于较高的水分去除率导致脱水产品内外的压力差。因此,整个基质被拖向中心,导致样品形状发生明显变化(Aprajeeta 等人,2015 年)。同样,Nawirska和 Biesiada(2009 年)也发现,用冷冻干燥法脱水的南瓜片显示出最小的干燥收缩。与冷冻干燥样品相比,对流干燥样品和真空干燥样品的收缩率更大。至于 FD-FIRD 样品,FD35-FIRD1 和 FD25-FIRD2 的体积收缩率分别为 6.64 ± 0.68 % 和 8.79 ± 0.46 %,显示出与 FD 样品相似的外观。这可能是由于当脱脂过程达到 25 小时时,大部分游离水(87.29%)被去除,SUP 切片的原始组织结构在很大程度上得以保留。因此,后来的样品几乎没有变形。
硬度指的是干燥产品第一次压缩的最大峰值力。图 2 显示了采用不同干燥技术的 SUP 干片的硬度变化。我们注意到,FIRD 样品的硬度值最高,达到 11333.41 ± 115.90 克,而 FD 样品的硬度值最低(5093.41 ± 85.90 克)。这可能是由于冰晶升华过程中形成了多孔结构,导致质地疏松呈海绵状。从表 1E 中还可以看出,FD 样品具有柔软多孔的表面结构。此外,热干燥过程中纤维和果胶化合物的变化导致细胞壁的硬度增加,从而使 FIRD 样品比 FD 样品更硬。如表 1A 所示,FIRD 样品收缩严重,表面形成坚硬的纹理。Feng 等人(2021 年)也发现了干蒜样品的硬度与收缩程度呈正相关。这表明,与 FD 样品的松散网络结构相比,SUP 切片在热干燥过程中的严重收缩会导致质地更硬。至于 FD-FIRD 样品,与 FD 相比,FD15-FIRD4、FD25-FIRD2 和 FD35-FIRD1 的硬度显著增加(分别为 1.46、1.25 和 1.14 倍)。然而,这种硬度的增加远远低于 FIRD。由于 FD-FIRD 产品的硬度适当,因此可以提高运输的便利性。
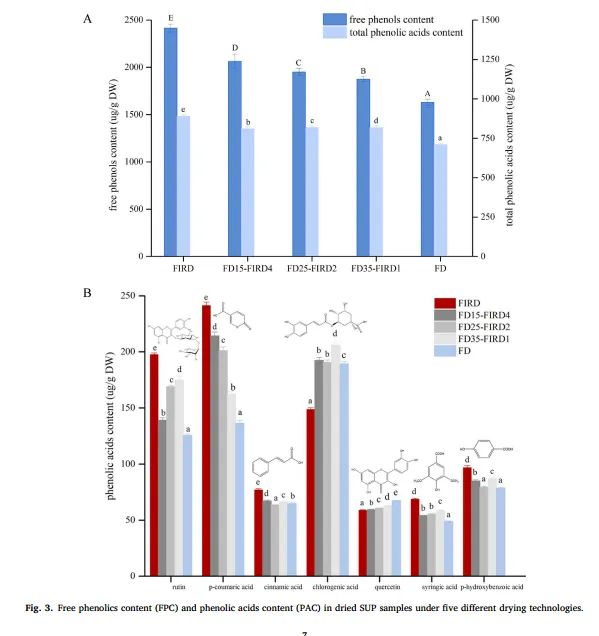
图3. 五种不同干燥技术下干燥 SUP 样品中的游离酚含量(FPC)和酚酸含量(PAC)
酚类化合物是多种生物功能的主要成分,包括抗氧化、抗菌、抗酪氨酸酶、抗炎和抗肿瘤。图 3 显示了采用不同干燥技术后 SUP 切片游离酚含量(FPC)和酚酸含量(PAC)的变化。FIRD 样品的游离酚和酚酸含量明显较高(分别为 2413.42 ± 42.56 μg/g DW 和 889.66 ± 9.27 μg/g DW),而 FD 样品的游离酚和酚酸含量相对较低(分别为 1629.79 ± 32.95 μg/g DW 和 710.18 ± 8.93 μg/g DW)。FIRD 样品中游离酚和酚酸的明显增加可能是由于 FIR 辐射通过分子振动转化为热量,并迅速被样品中心吸收所致(Ratseewo 等人,2020 年)。这一干燥过程可释放与结构成分(如纤维素、半纤维素、木质素、结构蛋白和碳水化合物)相连的结合酚,并激活小分子酚类化合物,从而导致干燥 SUP 中的游离酚和酚酸增加(Ratseewo 等人,2020 年)。最明显的是,在 FD25-FIRD2 中观察到更高的游离酚,与 FD 相比增加了 19.65%(图 3A)。这一现象可能与冻干过程中冰晶的形成导致细胞膜破裂和细胞壁果胶网络松散有关,这一过程提高了多酚类物质的提取率。同时,接下来的 FIRD 过程进一步抑制了酶诱导降解的减少,从而引发了游离酚的增加。与 FD25-FIRD2 的曝晒时间(2 小时)相比,FD15-FIRD4 更长的 FIR 曝晒时间(4 小时)能更好地释放结合酚,从而使游离酚显著增加。
在 FD、FIRD 和 FD-FIRD 产品中鉴定出以下七种酚酸:对香豆酸、绿原酸、对羟基苯甲酸、芦丁、丁香酸、肉桂酸和槲皮素(图 3B)。对香豆酸是所有干 SUP 样品中检测到的最主要的酚酸,其中 FIRD 样品中的含量最高(241.50 ± 0.88 μg/g DW)。值得注意的是,香豆酸的含量似乎与 FIR 的暴露时间呈正相关:FD15-FIRD4(4 小时)为 214.27 ± 0.45 μg/g DW,FD35-FIRD1(1 小时)为 162.28 ± 0.43 μg/g DW。原因之一是 FIR 可诱导对香豆酸和半纤维素之间的酯键分解。另一个原因是对香豆酸具有良好的热稳定性。此外,FD35-FIRD1 的绿原酸含量最高(206.13 ± 3.61 μg/g DW),这与脱脂过程中氧引起的氧化反应减少有关。根据先前的研究,由于存在易氧化和不稳定的酯键以及不饱和双键,高干燥温度和富氧环境可能会诱发绿原酸的异构化。同时,FD 样品与 FIRD 样品相比,槲皮素含量增加了 1.14 倍。有趣的是,与 FIRD 样品中的芦丁含量相比,FD15-FIRD4 中的芦丁含量明显下降了 72%,其次是 FD25-FIRD2(61%)和 FD35-FIRD1(55%)。芦丁含量的这种变化可能是由于脱脂过程结束时的残余水含量造成的。Ranieri 等人(2019 年)也曾发现,脱水过程结束时的残余水分含量会影响接下来干燥过程中芦丁含量的变化,且较高的残留水分会导致芦丁的损失。如上所述,酚酸含量受到不同干燥技术不同程度的影响,这可能是由于干燥过程中酚酸与其他化合物(即果胶、纤维素和蛋白质)之间的相互作用发生了变化或酚酸的结构发生了变化。此外,在保存 SUP 的酚类化合物方面,FD-FIRD 是一种可行的替代方法,甚至可能优于 FIRD。
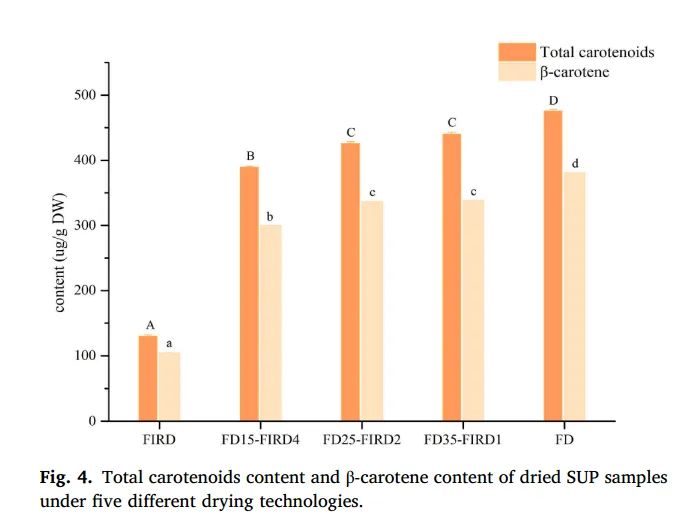
图4. 五种不同干燥技术下干燥的 SUP 样品的类胡萝卜素总含量和 β-胡萝卜素含量
经常食用富含类胡萝卜素的食物对健康有很多好处,如抗炎、预防慢性疾病、抗衰老等(Mapelli Brahm 等人,2020 年)。图 4 显示了采用不同干燥技术后 SUP 切片类胡萝卜素含量的变化。结果表明,与其他干燥方法相比,FD 样品的类胡萝卜素和 β-胡萝卜素含量最高(分别为 475.68 ± 2.49 μg/g DW 和 380.54 ± 0.46 μg/g DW)。Ye 等人(2019 年)也曾报道过类似的结果。他们指出,冷冻干燥能保护类胡萝卜素不受光照、高温和氧气的影响。一般来说,热干燥比非热干燥造成的类胡萝卜素损失更严重。类胡萝卜素含量的最大降幅出现在热风干燥中。以前的研究也证明,热风干燥和冷风干燥不利于保留β-胡萝卜素含量。这主要是由于氧气的存在引发了类胡萝卜素的降解。此外,Beta 和 Hwang(2018 年)也证明,原始的反式结构类胡萝卜素在暴露于热环境时会转化为顺式结构。FD25-FIRD2中类胡萝卜素和β-胡萝卜素的含量要高得多,分别是单独FIRD的3.28倍和3.23倍。此外,类胡萝卜素和β-胡萝卜素含量与FIRD持续时间密切相关,表明FIRD暴露时间长会导致类胡萝卜素和β-胡萝卜素含量降低。这可能是由于在冷冻干燥过程中,冰晶占据了样品中的空腔,从而形成了多孔结构。Harnkarnsujarit 和 Charoenrein(2011 年)发现,多孔结构的存在有利于氧合碳的保留。
为了补充单一 FD 和 FIRD 的优势,采用了 FD-FIRD 技术对 SUP 果肉进行脱水。结果表明,联合干燥转换点对最终产品的物理特性(颜色、微观结构、质地、收缩率)、生物活性成分(酚类和类胡萝卜素)有很大影响。应用 LFNMR 分析了脱水过程中的水分状态和分布,这有利于选择合适的联合干燥转换点。LFNMR 结果表明,当干燥时间达到 25 小时时,大部分游离水(87.29 %)被去除,果肉的原始组织结构得以保留。在此基础上,使用 FIRD 对样品进行进一步干燥,以获得优质产品(FD25-FIRD2)。FD25-FIRD2 样品的外观与干燥时间为 45 小时的单一 FD 样品相似,这表明 FD25-FIRD2 方法大大缩短了 FD 时间。此外,FD-FIRD 样品的 FPC 比单一 FD 样品高 14.97 %~26.60 %。特别是 FD25-FIRD2 样品的对香豆酸含量提高了 32.23%。此外,FD-FIRD 样品的类胡萝卜素保留率比 FIRD 样品高 3.00-3.39 倍。总之,FD25-FIRD2 方法既能降低能耗,又能确保最终产品的良好理化质量。
文章转载自:浙工大食品营养健康Lab
电话:400-060-3233
售后:400-060-3233


返回顶部